پیچیدگی روزافزون فرمولاسیونهای دارویی و تجهیزات پزشکی، نیاز به استفاده از مواد پیشرفتهای مانند مولکولارسیوها را برای بهبود کارایی، پایداری و ایمنی بیمار دوچندان کرده است.
رشد بازار زئولیتها، که نشاندهنده گسترش کاربردهای صنعتی آنها از جمله در حوزه داروسازی است، گواهی بر این مدعاست. در واقع، استانداردهای کیفی سختگیرانهتر، توسعه مولکولهای زیستی و داروهای بسیار حساس، و نیاز به دقت بالا در عملکرد تجهیزات پزشکی، تقاضا برای این مواد را در این بخشهای با ارزش افزوده بالا افزایش داده است.
این امر نشاندهنده یک روند به سمت انتخاب مواد تخصصی در این صنایع است، چرا که داروهای نوین، بهویژه بیولوژیکها و فرمولاسیونهای پیشرفته، اغلب به رطوبت، حلالها یا سایر ناخالصیها حساس هستند و تجهیزات پزشکی مانند تغلیظکنندههای اکسیژن برای ایمنی بیمار به خروجیهایی با خلوص بسیار بالا نیاز دارند.
در ادامه این مقاله، کاربردهای کلیدی این محصول در تولید و کنترل کیفیت دارو، سیستمهای نوین دارورسانی، تجهیزات پزشکی و خالصسازی داروهای بیولوژیک، همراه با چشمانداز رگولاتوری و نوآوریهای آتی مورد بحث و بررسی قرار خواهد گرفت.
فهرست مطالب
Toggleنقش مولکولارسیوها در تولید و کنترل کیفیت دارو
مولکولارسیوها به دلیل قابلیتهای منحصر به فرد خود در جذب انتخابی، نقش کلیدی در مراحل مختلف تولید و تضمین کیفیت محصولات دارویی ایفا میکنند. از خشککردن حلالها و مواد اولیه گرفته تا حفاظت از محصولات نهایی در بستهبندی، این مواد به بهبود خلوص، پایداری و در نهایت اثربخشی داروها کمک شایانی مینمایند.
خشککردن و خالصسازی حلالها، واکنشگرها و مواد موثره دارویی (APIs)
در سنتز مواد موثره دارویی (APIs)، حضور مقادیر حتی ناچیز آب در حلالها، واکنشگرها یا حدواسطها میتواند منجر به واکنشهای جانبی ناخواسته، تجزیه APIs، کاهش بازده واکنش یا تغییر در پروفایل ناخالصیها شود. مولکولارسیو، بهویژه انواع 3A و 4A، به طور گسترده برای دهیدراسیون حلالهای آلی مانند اتانول، متانول، استون و دیکلرومتان تا سطوح بسیار پایین رطوبت، اغلب کمتر از 0.1% یا حتی تا سطوح ppm، به کار میروند.
مکانیسم عمل به این صورت است که نوع 3A، با قطر حفرات تقریبی 3 آنگستروم (Å)، به طور انحصاری مولکولهای آب را جذب میکند در حالی که اکثر مولکولهای حلال آلی (که بزرگتر از 3Å هستند) را عبور میدهد.
این ویژگی، نوع 3A را برای خشککردن حلالهای قطبی مانند اتانول و متانول که در سنتز API کاربرد فراوان دارند، ایدهآل میسازد.
نوع 4A، با حفرات 4Å، علاوه بر آب میتواند مولکولهای کمی بزرگتر مانند CO2 یا H2S را نیز جذب کند و برای خشککردن عمومی حلالها و گازها مفید است. به عنوان مثال، دهیدراسیون اتانول برای تولید اتانول با گرید دارویی یا سوختی و خشککردن واکنشگرها و حدواسطها در سنتز چند مرحلهای API برای جلوگیری از هیدرولیز یا واکنشهای ناخواسته از کاربردهای رایج است.
علاوه بر خشککردن، این ماده میتواند در خالصسازی مخلوطهای واکنشی نیز نقش داشته باشد. اگر اندازه مولکولی محصولات جانبی یا مواد اولیه واکنشنکرده اجازه ورود به حفرات را بدهد در حالی که محصول مورد نظر به دلیل اندازه بزرگتر عبور کند، جداسازی انتخابی امکانپذیر میشود.
یکی از مزایای قابل توجه استفاده از این محصول، دستیابی به نقاط شبنم بسیار پایین (به عنوان مثال، 100- درجه سانتیگراد برای خشککردن گاز با نوع 4A) است که اغلب با سایر خشککنها مانند سیلیکاژل، بهویژه در سطوح پایین رطوبت باقیمانده، قابل دستیابی نیست.
استفاده از آن برای خشککردن فوقالعاده در سنتز API مستقیماً بر خلوص، پایداری و طول عمر دارو تأثیر میگذارد و به کیفیت کلی محصول و ایمنی بیمار کمک میکند.
از آنجایی که APIs اجزای فعال داروها هستند و خلوص و پایداری آنها بسیار حیاتی است و آب یک واکنشدهنده رایج در مسیرهای تجزیه (مانند هیدرولیز) برای بسیاری از مولکولهای آلی از جمله APIs است، توانایی نوع 3A و 4A در کاهش محتوای آب به سطوح بسیار پایین در حلالهای آلی مورد استفاده در سنتز API ، واکنشهای تجزیه را به حداقل رسانده و منجر به خلوص و پایداری بالاتر API میشود.
بنابراین، این محصول نه تنها یک ابزار کمکی، بلکه یک فناوری حیاتی برای تضمین کیفیت و اثربخشی محصول دارویی نهایی هستند. این بدان معناست که سرمایهگذاری در چنین مراحل خالصسازی برای بسیاری از فرآیندهای دارویی غیرقابل اجتناب است.

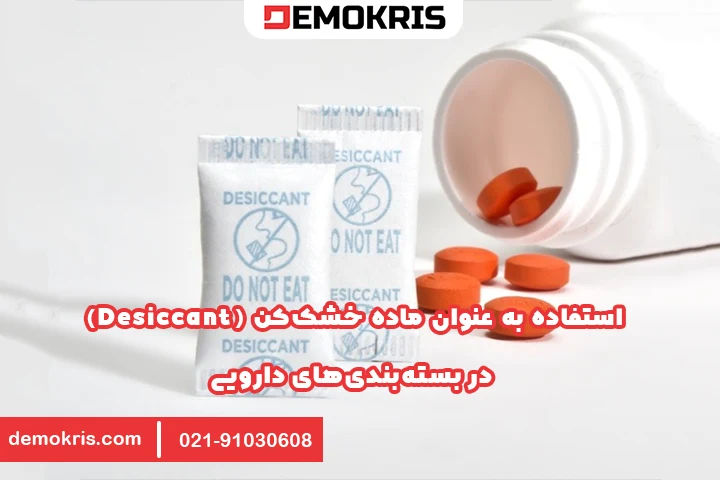
استفاده به عنوان ماده خشککن (Desiccant) در بستهبندیهای دارویی
زئولیتهای سنتزی به عنوان خشککنهای بسیار کارآمد در بستهبندیهای دارویی برای محافظت از محصولات حساس به رطوبت مانند قرصها، کپسولها، پودرها، APIs، معرفهای تشخیصی و تجهیزات پزشکی در برابر تجزیه استفاده میشوند.
مکانیسم عمل آنها جذب رطوبت از فضای خالی داخل بستهبندی و حفظ محیطی با رطوبت نسبی (RH) پایین است که از تجزیه شیمیایی (مانند هیدرولیز)، تغییرات فیزیکی (مانند کلوخه شدن، تغییر در سرعت انحلال) و کاهش قدرت دارو جلوگیری میکند.
در مقایسه با سیلیکاژل، این محصول ظرفیت جذب رطوبت بالاتری، بهویژه در سطوح پایین RH و در دماهای بالا، از خود نشان میدهند؛ شرایطی که عملکرد سیلیکاژل کاهش یافته و حتی ممکن است رطوبت جذبشده را آزاد کند. همچنین، این مواد سرعت جذب بالاتری دارند.
این ویژگیها آنها را برای داروهای بسیار حساس به رطوبت یا داروهایی که در طول نگهداری و حمل و نقل در معرض شرایط دمایی متغیر قرار میگیرند، ارجحیت میبخشد. در دسترس بودن اندازههای مختلف حفرات (مانند مولکولارسیو 3A و 4A) امکان جذب انتخابی آب را بدون جذب مواد موثره دارویی فراهم میکند، مشروط بر اینکه مولکولهای دارو بزرگتر از اندازه حفرات باشند.
کیسههای خشککن حاوی این ماده برای استفاده دارویی باید با استانداردهایی مانند فصل فارماکوپه ایالات متحده (USP) تحت عنوان “اجزای بستهبندی کمکی”، مقررات FDA ایالات متحده (اغلب در یک فایل اصلی دارویی FDA یا DMF ثبت میشوند) و ISO 15378 (GMP برای مواد بستهبندی اولیه) مطابقت داشته باشند.
همچنین، فصل فارماکوپه ایالات متحده تحت عنوان “ظروف – آزمون عملکرد” شامل استفاده از این مواد به عنوان خشککنهای استاندارد مرجع در آزمون سرعت انتقال بخار آب (MVTR) برای بستهبندیهایی مانند بلیسترها است.
انتخاب بین مولکولارسیو و سیلیکاژل به عنوان خشککن در بستهبندی دارویی یک تصمیم مبتنی بر ارزیابی ریسک-فایده-هزینه است که به شدت تحت تأثیر میزان حساسیت محصول دارویی به رطوبت، ارزش آن و پایداری مورد نیاز در طول عمر مفید تحت شرایط اقلیمی مختلف قرار دارد. این ماده محافظت برتری، بهویژه در RH پایین و دماهای بالا، ارائه میدهند، در حالی که سیلیکاژل عموماً ارزانتر است.
برای داروهای بسیار حساس یا با ارزش بالا، بهترین محافظت ممکن برای تضمین اثربخشی و جلوگیری از ضرر اقتصادی ناشی از فساد محصول ضروری است. نهادهای نظارتی برای تأیید محصولات دارویی به دادههای پایداری نیاز دارند و بستهبندی نقش کلیدی در این زمینه ایفا میکند.
بنابراین، برای داروهایی که به شدت به رطوبت حساس هستند یا به عمر مفید طولانی در بازارهای جهانی متنوع (با دما و رطوبت متفاوت) نیاز دارند، هزینه بالاتر این ماده با محافظت بیشتر و اطمینان نظارتی که ارائه میدهند، توجیهپذیر است. این امر نشاندهنده تقسیمبندی بازار برای خشککنها در صنعت داروسازی است.
جدول ۱: مقایسه مولکولارسیوها و سیلیکاژل به عنوان خشککنهای دارویی
| ویژگی | مولکولارسیو | سیلیکاژل |
|---|---|---|
| ساختار | کریستالی با حفرات یکنواخت و معین | آمورف با حفرات نامنظم |
| ظرفیت جذب در RH پایین (<40%) | به طور قابل توجهی بالاتر از سیلیکاژل | کمتر از زئولیت؛ در RH بالای 40% (در 25°C) عملکرد بهتری نسبت به زئولیت دارد |
| سرعت جذب | عالی، سریعتر از سیلیکاژل | خوب |
| حفظ رطوبت در دمای بالا | عالی، رطوبت را حتی در دماهای بالا به خوبی حفظ میکند | با افزایش دما کاهش مییابد و ممکن است رطوبت را آزاد کند |
| هزینه نسبی | گرانتر | ارزانتر |
| کاربردهای دارویی متداول | محصولات بسیار حساس به رطوبت، نیاز به RH بسیار پایین، شرایط دمایی متغیر | کاربردهای عمومی، صرفهجویی در هزینه |
خالصسازی گازهای بیهوشی
زئولیتها در تضمین پایداری و خلوص گازهای بیهوشی استنشاقی مانند سووفلوران نقش دارند. حضور آب باقیمانده در سووفلوران میتواند منجر به تجزیه آن و تشکیل بالقوه اسید هیدروفلوئوریک شود که قادر است ظروف شیشهای را خورده و تجزیه بیشتر را کاتالیز کند.
برای جلوگیری از این مشکل، از زئولیتهای حاوی آلومینا برای خشککردن سووفلوران تا سطوح ناچیز آب (به عنوان مثال، کمتر از ppm 130، و در حالت ایدهآل ppm 30-0) استفاده میشود تا پایداری طولانیمدت حتی در ظروف شیشهای استاندارد و در دماهای بالا تضمین گردد.
نکته قابل توجه این است که سووفلوران “بدون آب”، که از طریق خشککردن (حتی آنهایی که دارای خواص اسید لوئیس مانند انواع حاوی آلومینا هستند) به دست میآید، برخلاف نگرانیهای قبلی در مورد کاتالیز تجزیه توسط اسیدهای لوئیس، دچار تجزیه نمیشود. این یافته نشان میدهد که آب عامل اصلی در فرآیند تجزیه است.
استفاده از این محصول برای خشککردن سووفلوران یک مرحله کنترل کیفیت حیاتی است که با جلوگیری از تشکیل محصولات تجزیه مضر و تضمین پایداری و دوز صحیح ماده بیهوشی، مستقیماً بر ایمنی بیمار تأثیر میگذارد.
سووفلوران یک ماده بیهوشی استنشاقی است که به بیماران تجویز میشود و وجود اسید هیدروفلوئوریک (یک ماده خورنده و سمی) در آن یک خطر ایمنی قابل توجه خواهد بود. توانایی این مواد در حذف آب تا سطوحی که از این تجزیه جلوگیری میکند ، آنها را به یک اقدام ایمنی اساسی در تولید و نگهداری این ماده بیهوشی تبدیل میکند.
کشف اینکه زئولیتهای حاوی آلومینا (اسیدهای لوئیس) میتوانند برای خشککردن سووفلوران بدون ایجاد تجزیه استفاده شوند، مادامی که آب حذف شود، درک قبلی از شیمی پایداری سووفلوران را اصلاح میکند.
پیش از این تصور میشد که اسیدهای لوئیس (مانند اکسیدهای آلومینیوم) تجزیه سووفلوران را کاتالیز میکنند. مواد حاوی آلومینا عوامل خشککننده مؤثری هستند اما دارای جایگاههای اسید لوئیس نیز میباشند.
پتنت نشان میدهد که اگر سووفلوران با استفاده از این غربالها تا سطوح بسیار پایین آب خشک شود، پایدار باقی میماند. این امر نشان میدهد که آب یک کوفاکتور ضروری برای تجزیه کاتالیز شده توسط اسید لوئیس است، یا اینکه مسیر اصلی تجزیه توسط آب هدایت میشود و اسیدهای لوئیس تنها در حضور آب کافی آن را تسریع میکنند.
این درک اصلاحشده امکان استفاده از روشهای مؤثرتر و بالقوه پایدارتر برای تثبیت سووفلوران را فراهم میکند.

سیستمهای نوین دارورسانی با بهرهگیری از مولکولارسیوها
این مواد بهویژه در مقیاس نانو، به عنوان بسترهای امیدوارکنندهای برای توسعه سیستمهای دارورسانی پیشرفته (DDS) ظهور کردهاند. ساختار متخلخل منحصر به فرد، قابلیت اصلاح سطح و خواص قابل کنترل آنها، امکان دارورسانی هدفمند و کنترلشده را فراهم میآورد.
نانوذرات بر پایه زئولیت برای دارورسانی هدفمند و کنترلشده
نانوذرات مبتنی بر زئولیت (شامل چارچوبهای زئولیتی ایمیدازولات – ZIFs) به عنوان پلتفرمهای نوظهور برای سیستمهای دارورسانی پیشرفته مورد توجه قرار گرفتهاند. مکانیسمهای اصلی عملکرد آنها عبارتند از:
- کپسولهسازی: داروها درون ساختار متخلخل زئولیتها/ZIFs به دام میافتند و از تجزیه زودرس محافظت میشوند.
- رهایش حساس به pH: بسیاری از ZIFها (مانند ZIF-8) و برخی زئولیتها به pH حساس هستند و در محیطهای اسیدی (مانند ریزمحیط تومور یا بخشهای درون سلولی خاص) تجزیه شده یا ساختارشان تغییر میکند، که منجر به رهایش انتخابی دارو در محل هدف میشود.
- عاملدار کردن سطح: سطح خارجی نانوذرات زئولیت را میتوان با پلیمرها، لیگاندهای هدفمند و غیره اصلاح کرد تا زیستسازگاری، زمان گردش در خون و هدفگیری فعال به سلولها یا بافتهای خاص بهبود یابد.
- رهایش کنترلشده: ساختار متخلخل ذاتی و پتانسیل اصلاح، امکان تنظیم سینتیک رهایش دارو (مانند رهایش پایدار، رهایش تأخیری) را فراهم میکند.
در زمینه دارورسانی ضد سرطان، این نانوذرات برای انتقال داروهایی مانند دوکسوروبیسین (DOX)، ۵-فلورواوراسیل (5-FU)، سیس پلاتین و کورکومین استفاده شدهاند. مطالعات نشان دادهاند که این سیستمها منجر به افزایش جذب سلولی و کاهش عوارض جانبی در مقایسه با تجویز معمولی داروها میشوند.
همچنین، امکان همرسانی چندین دارو (به عنوان مثال، DOX با یک مهارکننده P-گلیکوپروتئین) برای غلبه بر مقاومت چنددارویی و استفاده از سیستمهای پاسخگو به دو محرک (مانند pH و لیزر مادون قرمز نزدیک یا NIR) برای افزایش ویژگی وجود دارد.
حساسیت به pH در برخی زئولیتها/ZIFs یک ویژگی بسیار قدرتمند برای دارورسانی ضد سرطان است، زیرا از یک تفاوت فیزیولوژیکی بین بافتهای سرطانی و سالم (ریزمحیط اسیدی تومور) بهره میبرد.
ریزمحیط تومور اغلب اسیدیتر (pH پایینتر) از pH فیزیولوژیکی طبیعی است. برخی ساختارهای زئولیت/ZIF در pH پایینتر ناپایدار هستند و محموله دارویی خود را تجزیه یا آزاد میکنند. با کپسوله کردن داروهای ضد سرطان در این نانوذرات حساس به pH، دارو میتواند به طور ترجیحی در محل تومور آزاد شود.
این رهایش هدفمند میتواند غلظت دارو را در تومور افزایش داده و اثربخشی را بهبود بخشد، در حالی که قرار گرفتن بافتهای سالم در معرض داروی سیتوتوکسیک را به حداقل میرساند و در نتیجه عوارض جانبی را کاهش میدهد. این یک هدف کلیدی در درمان سرطان مدرن است.
مولکولارسیو 4A یکی از پرمصرفترین گریدهای این محصول در صنایع داروسازی میباشد.

افزایش پایداری و فراهمی زیستی داروها
کپسولهسازی درون چارچوب زئولیت میتواند مولکولهای دارویی ناپایدار را از تجزیه آنزیمی، هیدرولیز یا اکسیداسیون در محیط بیولوژیکی قبل از رسیدن به هدف محافظت کند. رهایش کنترلشده از زئولیتها میتواند پروفایل فارماکوکینتیک دارو را بهبود بخشد، به طور بالقوه غلظتهای درمانی را برای مدت طولانیتری حفظ کرده و دفعات مصرف دارو را کاهش دهد.
برای داروهای با حلالیت ضعیف، فرمولاسیون با زئولیتها (به عنوان مثال، به صورت کمپلکسهای زئولیت-سورفکتانت یا با بهبود پراکندگی) ممکن است سرعت انحلال و در نتیجه فراهمی زیستی آنها را افزایش دهد، اگرچه این بیشتر یک کاربرد استنباطی بر اساس اصول کلی دارورسانی و خواص زئولیت مانند سطح ویژه بالا است.
افزایش پایداری دارو از طریق کپسولهسازی با زئولیت بهویژه برای داروهای بیولوژیک (پروتئینها، پپتیدها، اسیدهای نوکلئیک) که اغلب مستعد تجزیه هستند، ارزشمند است و به طور بالقوه میتواند مسیرهای تجویز را گسترش داده یا اثربخشی این درمانهای حساس را بهبود بخشد. داروهای بیولوژیک به طور فزایندهای مهم هستند اما اغلب ناپایدار و مستعد تجزیه میباشند.
زئولیتها میتوانند مولکولهای دارو را کپسوله و محافظت کنند و حفرات آنها را میتوان برای جای دادن مولکولهایی با اندازههای مختلف تنظیم کرد.
بنابراین، زئولیتها میتوانند یک محیط محافظ برای بیولوژیکها فراهم کنند، عمر مفید آنها را بهبود بخشیده یا از آنها در طول عبور از بدن محافظت کنند (به عنوان مثال، تحویل خوراکی پپتیدها در صورت محافظت از آنزیمهای معده). این امر میتواند منجر به مسیرهای تحویل کمتر تهاجمی یا درمانهای مؤثرتر شود.
عوامل فیزیکوشیمیایی و ملاحظات ایمنی
چندین عامل فیزیکوشیمیایی کلیدی زئولیتها بر عملکرد آنها به عنوان حامل دارو تأثیر میگذارند :
- نسبت Si/Al: بر بار سطحی، آبدوستی و قدرت برهمکنش با داروها تأثیر میگذارد. نسبتهای پایین Si/Al (آلومینیوم بیشتر) میتواند پیوند هیدروژنی با برخی داروها را تسهیل کند اما ممکن است پایداری را در محیطهای اسیدی کاهش دهد. نسبتهای بالای Si/Al منجر به زئولیتهای آبگریزتر میشود.
- اندازه و هندسه حفرات: باید برای اندازه مولکول دارو مناسب باشد تا امکان کپسولهسازی و رهایش فراهم شود. سطح ویژه بزرگتر معمولاً به معنای ظرفیت بارگذاری داروی بالاتر است.
- آبدوستی: بر رهایش دارو در محیطهای آبی تأثیر میگذارد؛ آبدوستی بالاتر میتواند منجر به هیدراتاسیون سریعتر و رهایش دارو شود. اندازه ذرات: ذرات کوچکتر سطح ویژه خارجی بزرگتری برای برهمکنش با دارو ارائه میدهند که اگر جذب عمدتاً روی سطح باشد، مهم است.
- ظرفیت تبادل کاتیونی (CEC): میتوان از آن برای اتصال داروهای کاتیونی یا برای رفتار پاسخگو به pH استفاده کرد.
در مورد ایمنی و زیستسازگاری، در حالی که بسیاری از زئولیتها (مانند کلینوپتیلولیت) زیستسازگار در نظر گرفته میشوند، برخی از انواع (مانند زئولیتهای فیبری مانند اریونیت) سیتوتوکسیک یا سرطانزا شناخته شدهاند. سمیت میتواند به اندازه ذرات، شکل و ترکیب (مانند محتوای آلومینا) بستگی داشته باشد.
نانوذرات زئولیت نیاز به ارزیابی سمشناسی دقیق دارند. سطح داخلی زئولیتها به طور کلی با محیط بیولوژیکی برهمکنش نمیکند که برخی نگرانیهای مربوط به سمیت را در صورت پایدار بودن ذرات کاهش میدهد. نهادهای نظارتی قبل از تأیید سیستمهای دارورسانی مبتنی بر زئولیت به دادههای ایمنی گستردهای نیاز خواهند داشت.

جدول ۲: عوامل فیزیکوشیمیایی کلیدی زئولیتها و تاثیر آنها بر عملکرد به عنوان حامل دارو
| عامل فیزیکوشیمیایی | تاثیر بر بارگیری/رهایش دارو | ملاحظات |
|---|---|---|
| نسبت Si/Al | برهمکنشهای الکترواستاتیک، پیوند هیدروژنی، آبدوستی/آبگریزی، سینتیک رهایش | پایداری در محیطهای مختلف (مثلاً اسیدی)، انتخابپذیری جذب |
| اندازه و هندسه حفرات | ظرفیت بارگذاری دارو، امکان ورود و خروج مولکول دارو، کنترل سرعت رهایش | انتخابپذیری بر اساس اندازه مولکول دارو، جلوگیری از تجزیه داروهای بزرگ |
| آبدوستی | سرعت هیدراتاسیون، ترشوندگی، سرعت رهایش دارو در محیط آبی | برهمکنش با محیط بیولوژیکی، پایداری کلوئیدی |
| اندازه ذرات | سطح ویژه خارجی، سرعت انحلال (برای ذرات)، جذب سلولی (برای نانوذرات) | پتانسیل سمیت (نانوذرات)، پایداری سوسپانسیون |
| ظرفیت تبادل کاتیونی (CEC) | امکان اتصال داروهای کاتیونی، رهایش پاسخگو به یون، فعالیت ضد اسیدی | انتخابپذیری برای کاتیونهای خاص، تأثیر بر فارماکوکینتیک |
| اصلاحات سطحی | بهبود بارگذاری دارو، کنترل رهایش، افزایش زیستسازگاری، هدفگیری فعال | پیچیدگی سنتز، پایداری پوشش، پتانسیل سمیت عوامل اصلاحکننده |
مولکولارسیوها در تجهیزات و دستگاههای پزشکی
این مواد به دلیل توانایی خود در جداسازی گازها و حذف رطوبت، در طیف وسیعی از تجهیزات پزشکی، از جمله دستگاههای حیاتی مانند تغلیظکنندههای اکسیژن و تجهیزات تنفسی، کاربرد دارند.
دستگاههای تغلیظکننده اکسیژن پزشکی
دستگاههای تغلیظکننده اکسیژن پزشکی از این مواد (معمولاً نوع مولکولارسیو 13X یا زئولیتهای تخصصی تبادلشده با لیتیوم، LiX) در فرآیندی به نام جذب نوسان فشار (PSA) برای تولید هوای غنی از اکسیژن جهت استفاده درمانی بهره میبرند.
مکانیسم PSA به این صورت عمل میکند:
- هوا فشرده شده و از ستونی (بستر غربال) پر از پلتهای زئولیت عبور داده میشود.
- در فشار بالا، زئولیت به طور انتخابی نیتروژن را از هوا جذب میکند. این جذب به دلیل اندازه مولکولی بزرگتر نیتروژن و/یا برهمکنش قویتر آن با سطح زئولیت در مقایسه با اکسیژن است. آرگون نیز تا حدی جذب میشود.
- اکسیژن که کمتر جذب میشود، از ستون عبور کرده و در یک مخزن جمعآوری میشود و غلظت اکسیژن معمولاً به بیش از 95-90% میرسد.
- به طور همزمان، یک بستر غربال دوم (در یک سیستم دو بستره) تحت بازسازی قرار میگیرد: فشار کاهش یافته و باعث دفع نیتروژن جذبشده از زئولیت و تخلیه آن به اتمسفر میشود. سپس بسترها نقش خود را عوض میکنند و امکان تأمین مداوم اکسیژن فراهم میشود.
اندازه حفرات، سطح ویژه و خصوصیات شیمیایی زئولیت در جذب کارآمد نیتروژن اهمیت زیادی دارد. زئولیتهای لیتیوم X (LiX) به دلیل ظرفیت بالای جذب نیتروژن و انتخابپذیری، امکان ساخت تغلیظکنندههای اکسیژن قابل حمل (POCs) فشردهتر و کارآمدتر را فراهم کردهاند.
این فناوری برای تولید اکسیژن در مقیاس کوچک تا متوسط، قابل اعتماد، اقتصادی و از نظر انرژی کارآمدتر از روشهای دیگر مانند جداسازی برودتی در این مقیاسها است.

خالصسازی هوا در تجهیزات تنفسی
این مواد در کارتریجهای فیلتراسیون دستگاههای تنفسی مانند دستگاههای تنفسی خودکفا (SCBA) که توسط آتشنشانان و در سایر محیطهای خطرناک استفاده میشوند و به طور بالقوه در سایر سیستمهای تأمین هوای پزشکی کاربرد دارند.
نقش آنها حذف آلایندهها از هوای فشرده، عمدتاً رطوبت، و همچنین به طور بالقوه CO2 (در صورت استفاده از انواع خاص زئولیت) و سایر ناخالصیهای جزئی است تا اطمینان حاصل شود که هوای تأمینشده برای تنفس ایمن است.
اگرچه برخی منابع بر خطرات بهداشتی ناشی از کار با گرد و غبار این ماده تمرکز دارند ، اما این امر به طور ضمنی بر استفاده از آنها در سیستمهای تصفیه هوا که در آنها خلوص بسیار مهم است، دلالت دارد. ظرفیت بالای جذب آب، آنها را به خشککنهای مؤثری در این سیستمها تبدیل میکند.
در سیستمهای SCBA و هوای پزشکی، این مواد نه تنها با تأمین اکسیژن (در تغلیظکنندهها) بلکه با تضمین خلوص هوای قابل تنفس و حذف اجزای مضری که ممکن است در هوای فشرده وجود داشته باشند یا در اثر فرآیند فشردهسازی ایجاد شوند، به ایمنی کاربر کمک میکنند. سیستمهای SCBA هوای قابل تنفس را در محیطهایی که هوای محیط آلوده یا کم اکسیژن است، فراهم میکنند.
هوای فشرده میتواند حاوی رطوبت، بخارات روغن (از کمپرسورها) و سایر ذرات معلق باشد. این مواد در جذب آب عالی هستند و بسته به نوع، میتوانند سایر ناخالصیها را نیز به دام بیندازند. حذف این آلایندهها برای سلامت و ایمنی کاربر، جلوگیری از تحریک تنفسی یا اثرات بهداشتی شدیدتر، حیاتی است. بنابراین، این مادهها به عنوان یک مانع ایمنی حیاتی در این سیستمهای پشتیبانی حیات عمل میکنند.
جمعآوری و حذف گازهای بیهوشی هدررفته (WAGs)
مواد جاذب، از جمله مولکولارسیوهای آبگریز (زئولیتهای با سیلیس بالا) و کربن فعال، در سیستمهایی برای جذب گازهای بیهوشی هدررفته (مانند سووفلوران، ایزوفلوران، دسفلوران) که توسط بیماران بازدم میشوند یا از مدارهای بیهوشی در اتاقهای عمل خارج میشوند، استفاده میشوند. این جذب به دو دلیل اصلی مهم است:
- کاهش مواجهه شغلی پرسنل مراقبتهای بهداشتی با WAGs، که با اثرات بالقوه درازمدت بر سلامتی مرتبط است.
- کاهش تأثیر زیستمحیطی این گازها، زیرا بسیاری از آنها گازهای گلخانهای قوی هستند.
جریانهای گازی حاوی WAGs از بستری از ماده جاذب عبور داده میشوند که به طور انتخابی هیدروکربنهای هالوژنه را جذب میکند. مواد بیهوشی جذبشده به طور بالقوه میتوانند از جاذب بازیابی شوند (به عنوان مثال، با تخلیص با یک گاز بیاثر یا بخار، یا با حرارت دادن در خلاء) و سپس برای استفاده مجدد خالصسازی شوند، اگرچه کارایی و امکانسنجی اقتصادی بازیابی و بازفرآوری تا خلوص گرید پزشکی ملاحظات کلیدی هستند.
گزارش شده است که کارایی جذب در شرایط بالینی (in vivo) بین 73-25% متغیر است، در حالی که در شرایط آزمایشگاهی (in vitro) بیش از 95% است. زئولیتهای سیلیسی (آبگریز) به عنوان مواد مؤثر برای جذب گونههای آلی از جریانهای گازی حاوی رطوبت ذکر شدهاند، زیرا به طور انتخابی مواد آلی را جذب کرده و از جمعآوری بخار آب جلوگیری میکنند.
جداسازی و خالصسازی داروهای بیولوژیک
داروهای بیولوژیک، از جمله پروتئینهای نوترکیب و آنتیبادیهای مونوکلونال، به دلیل پیچیدگی ساختاری و حساسیت، نیازمند روشهای خالصسازی دقیق و کارآمد هستند. زئولیتها، از طریق اصول کروماتوگرافی غربال مولکولی، نقش مهمی در این زمینه ایفا میکنند.
کروماتوگرافی غربال مولکولی (کروماتوگرافی حذف اندازهای)
کروماتوگرافی حذف اندازهای (SEC)، که به عنوان کروماتوگرافی غربال مولکولی یا فیلتراسیون ژل نیز شناخته میشود، یک روش کروماتوگرافی است که مولکولها را بر اساس حجم هیدرودینامیکی آنها (اندازه و شکل در محلول) جدا میکند.
اصل این روش بر این اساس است که فاز ساکن از دانههای متخلخل (اغلب پلیمرهایی مانند دکستران، آگارز یا پلیآکریلآمید، اما اصل عمل مشابه غربالگری مولکولی توسط زئولیتها است که در آن حفرات مولکولها را بر اساس اندازه حذف یا شامل میکنند) تشکیل شده است.
مولکولهای بزرگتر که نمیتوانند وارد حفرات شوند ابتدا خارج میشوند، در حالی که مولکولهای کوچکتر که میتوانند به حفرات نفوذ کنند مسیر طولانیتری داشته و دیرتر خارج میشوند. جداسازی بر اساس حذف فیزیکی است و نه برهمکنش شیمیایی با فاز ساکن.
نتیجهگیری
مولکولارسیوها (زئولیتها) به دلیل ساختار متخلخل منحصر به فرد و قابلیت جذب انتخابی، نقشهای حیاتی و متنوعی در صنایع مدرن داروسازی و پزشکی ایفا میکنند. این مواد پیشرفته به طور قابل توجهی به بهبود فرآیندهای تولید دارو، کنترل کیفیت، توسعه سیستمهای نوین دارورسانی، عملکرد تجهیزات پزشکی و خالصسازی داروهای بیولوژیک کمک کردهاند.
از خشککردن فوقالعاده حلالها و مواد اولیه در سنتز API گرفته تا حفاظت از داروهای حساس به رطوبت در بستهبندیها، و همچنین تضمین پایداری گازهای بیهوشی، این مواد به عنوان ابزارهای ضروری برای دستیابی به خلوص و پایداری بالاتر محصولات دارویی شناخته میشوند.
در حوزه دارورسانی، نانوذرات مبتنی بر زئولیت پتانسیل امیدوارکنندهای برای تحویل هدفمند و کنترلشده داروها، بهویژه در درمان سرطان و بیماریهای عفونی، از خود نشان دادهاند.
در تجهیزات پزشکی، کاربرد آنها در دستگاههای تغلیظکننده اکسیژن و سیستمهای تصفیه هوای تنفسی، مستقیماً با ایمنی و رفاه بیماران و کاربران مرتبط است. علاوه بر این، نقش آنها در جمعآوری گازهای بیهوشی هدررفته، هم به بهداشت شغلی و هم به حفاظت از محیط زیست کمک میکند.
در نهایت، اصول غربال مولکولی در کروماتوگرافی حذف اندازهای، یک جزء اساسی در خالصسازی داروهای بیولوژیک پیچیده مانند آنتیبادیهای مونوکلونال است.
منابع
برای نوشتن این مقاله از مقالات معتبر و سایتهای مرجع انگلیسی استفاده شده است. برخی از منابع استفاده شده برای نگارش این مقاله به صورت زیر است:
- مقاله «Effects of Zeolite as a Drug Delivery System on Cancer Therapy: A Systematic Review» منتشر شده در سایت mdpi.com
- مفاله «Zeolite-Based Nanoparticles Drug Delivery Systems in Modern Pharmaceutical Research and Environmental Remediation» منتشر شده در سایت researchgate.net
- مقاله «The Science of Molecular Sieves for Water Removal: What You Need to Know» منتشر شده در سایت jalonzeolite.com
- مقاله «Scalable methods for purification of recombinant viruses» منتشر شده در سایت justia.com